|
丹皮酚对 β-1,3-葡聚糖诱导的小鼠巨噬细胞 Dectin-1 / NLRP3 信号 通路抑制作用研究【中医中药与免疫】丹皮酚对 β-1,3-葡聚糖诱导的小鼠巨噬细胞 Dectin-1 / NLRP3 信号 通路抑制作用研究一 文章信息 题目:丹皮酚对 β-1,3-葡聚糖诱导的小鼠巨噬细胞 Dectin-1 / NLRP3 信号 通路抑制作用研究 刊名:中医中药与免疫 作者:吴嘉迪 段强军 肖 楠等 单位:安徽中医药大学 日期:. 2020. 04
01摘要 目的:研究丹皮酚对 β-1,3-葡聚糖诱导的巨噬细胞上 Dectin-1 / NLRP3 信号通路的影响。 方法:培养小鼠 RAW264. 7 巨噬细胞,并分成空白对照组、β-1,3-葡聚糖诱导模型组、昆布多糖组和丹皮酚组,β-1,3-葡聚糖诱导巨噬细胞 24 h 建立 ALD 炎症模型。 通过 MTT 法检测细胞活性,通过倒置显微镜观察各组形态学变化,通过 Western blot 检测小鼠 RAW264. 7 巨噬细胞 Dectin-1、Syk、NLRP3、ASC、pro-caspase-1、caspase-1 蛋白的表达,通过 RT-qPCR 检测小鼠 RAW264. 7 巨噬 细胞 Dectin-1、NLRP3、caspase-1 mRNA 的表达,通过 ELISA 检测各组培养液中 IL-1β、IL-18 的分泌水平。 结果:MTT 结果表 明,与空白对照组相比,β-1,3-葡聚糖诱导模型组抑制细胞增殖活性减弱。 与 β-1,3-葡聚糖诱导模型组相比,丹皮酚干预后细 胞增殖活性增强。 形态学观察发现,空白对照组细胞体积小,形态圆润。 β-1,3-葡聚糖诱导后细胞体积变大,分化严重,形态 狭长。 丹皮酚干预后细胞分化减轻,细胞形态近似圆形。 Western blot、RT-qPCR 和 ELISA 结果表明,与空白对照组相比,β-1, 3-葡聚糖能显著升高巨噬细胞中 Dectin-1、 Syk、NLRP3、ASC、 pro-caspase-1、 caspase-1 的蛋白表达水平和 Dectin-1、NLRP3、 caspase-1 mRNA 表达水平以及细胞上清液 IL-1β、IL-18 的分泌水平。 而与 β-1,3-葡聚糖诱导模型组相比,经丹皮酚干预后可 明显降低巨噬细胞中 Dectin-1、Syk、NLRP3、ASC、pro-caspase-1、caspase-1 的蛋白表达水平和 Dectin-1、NLRP3、caspase-1 mRNA 表达水平以及细胞上清液 IL-1β、IL-18 的分泌水平。 结论:本研究结果表明丹皮酚可能通过抑制 β-1,3-葡聚糖诱导的 Dectin1 / NLRP3 信号通路上 Dectin-1、Syk、NLRP3、ASC、pro-caspase-1、caspase-1 的过表达从而有效降低终末炎症因子 IL-1β 及 IL-18 的释放,进而有效抑制 β-1,3-葡聚糖诱导的 ALD 炎症反应。
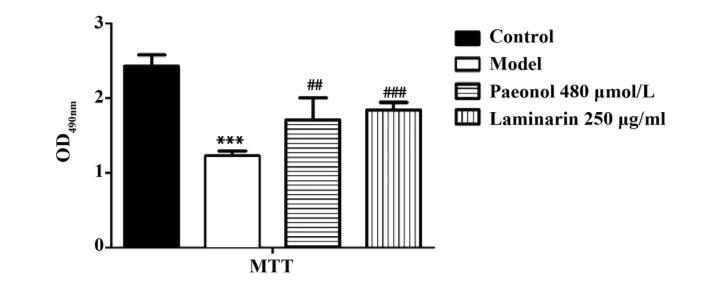
02关键词: 丹皮酚;β-1,3-葡聚糖;巨噬细胞;Dectin-1 / NLRP3 信号通路 03 材料方法 3.1材料 丹皮酚购自宣城市 百草植物工贸有限公司(纯度>99% );β-1,3-D-葡 聚糖、昆布多糖购自美国 Sigma 公司;胎牛血清购自 上海 HAKATA 公司;DMEM 高糖培养基购自美国 HyClone 公司;青霉素-链霉素溶液购自杭州碧云天 公司;Trizol 试剂购自美国 ambion 公司; 逆转录试 剂盒、SYBR 荧光染料购自日本东洋纺公司;抗小鼠 β-actin 抗体购自北京中杉金桥生物技术有限公司; 抗小鼠 Dectin-1 抗体购自美国 Santa Cruz 公司;抗 小鼠 caspase-1 抗体、抗小鼠 NLRP3 抗体和辣根过 氧化物酶标记二抗均购自美国 Affinity 公司;抗小鼠ASC 抗体和抗小鼠 Syk 抗体均购自沈阳万类生物科 技有限公司;ECL 发光液购自美国 Advansta 公司; PCR 引物采用 Primer 5. 0 设计,并由生工生物工程(上海)股份有限公司合成;小鼠 IL-1β、IL-18 ELISA试剂均购自泉州睿信生物科技有限公司。 3.2 方法 3.2.1 RAW264. 7 巨噬细胞培养及药物干预 将 冻存在-80℃ 冰箱的 RAW264. 7 巨噬细胞复苏后, 加入含 10% 的胎牛血清、100 U/ ml 青、链霉素的 DMEM 培养基中在 37℃ 、5% CO2 培养箱中培养 24 h,每天定期观察细胞生长状态,定期更换培养 基,当细胞达到对数生长期、融合度到 80% 以上时,将细胞进行分组,即空白对照组、β-1,3-D-葡聚糖诱 导模型组、昆布多糖组、丹皮酚干预组。 根据相关文 献以及前期模型和药物筛选结果[15-17] ,我们选用70 μg / ml β-1,3-D-葡聚糖造炎症模型,250 μg / ml 作为昆布多糖剂量,480 μmol / L 作为丹皮酚剂量。 空白对照组和 β-1,3-D-葡聚糖诱导模型组用 DMEM完全培养基对细胞进行培养 24 h,昆布多糖组用昆 布多糖(250 μg / ml) 对细胞进行干预 24 h,丹皮酚 干预组用丹皮酚 ( 480 μmol / L) 对细胞进行干预24 h,之后弃掉相应的培养基,除空白对照组加入新 鲜含血清的 DMEM 培养基继续培养 24 h 外,其余组 加入 70 μg / ml β-1,3-D-葡聚糖诱导 24 h,最后对四 组的培养液与细胞进行收集。 3.2.2 MTT 法检测巨噬细胞的增殖活性 接种 3× 10 5 ml -1 RAW264. 7 巨噬细胞于 96 孔板,待 24 h 完 全贴壁后,弃上清,加 PBS 清洗 3 遍,空白对照组和β-1,3-D-葡聚糖诱导模型组加入新鲜 DMEM 培养 基,丹皮酚干预组加入丹皮酚(480 μmol / L),昆布 多糖组加入昆布多糖(250 μg / ml),分别培养 24 h后,弃掉相应的培养基,除空白对照组加入新鲜含血 清的 DMEM 培养基继续培养 24 h 外,其余组加入 70 μg / ml β-1,3-D-葡聚糖诱导 24 h 后,避光加入5 mg / ml MTT 工作液 20 μl,放入二氧化碳培养箱避 光培养 2 h 后,弃上清,加入 200 μl DMSO 对沉着在 孔板底部的棕色甲臜沉淀进行溶解,室温放置摇床 低速振荡 10 min,酶标仪进行比色,测定 490 nm 波 长下吸光度值。 3.2.3倒置显微镜观察细胞形态 接种 3×10 5 个/ ml RAW264. 7 巨噬细胞于 6 孔板,待 24 h 完全贴壁 后,弃上清,加 PBS 清洗 3 遍,空白对照组和 β-1,3- D-葡聚糖诱导模型组用 DMEM 培养基对细胞进行 孵育 24 h,Dectin-1 抑制剂昆布多糖组用昆布多糖 (250 μg / ml)对细胞进行孵育 24 h,丹皮酚干预组 用丹皮酚(480 μmol / L)对细胞进行孵育 24 h,之后 弃掉相应的培养基,除空白对照组加入新鲜含血清 的 DMEM 培养基继续培养 24 h 外,其余组加入70 μg / ml β-1,3-D-葡聚糖诱导 24 h,之后弃上清,用 PBS 清洗 3 遍后,加入澄清 PBS,用倒置显微镜观察 各组细胞形态变化。 3.2.4 实时荧光定量 PCR 对巨噬细胞 Dectin-1、 NLRP3、caspase-1 mRNA 表达的检测 将处理过的 细胞用提前预冷的无菌 PBS 清洗 3 次后,用细胞刮 刀将细胞刮下来并收集到无酶 EP 管中,根据 RNA 提取试剂盒的步骤进行 RNA 提取。 之后根据逆转 录试剂盒的步骤进行反转录成 cDNA。 所有引物采用 Primer Premier 5. 0 软件设计,委托上海生工生物 有限公司合成,各引物序列见表 1。 RT-qPCR 反应 体系 25 μl: SYBR 荧 光 染 料 12. 5 μl, 上 游 引 物(100 μmol / L)1 μl,下游引物(100 μmol / L) 1 μl, cDNA 0. 5 μl,DEPC 水 10 μl。 在 ABI 7500 实时荧 光定量 PCR 仪上进行扩增反应,反应条件:预变性95℃ 1 min;扩增定量程序 40 个循环,循环参数:变 性 94℃ 15 s,退火 50℃ 15 s,延伸 72℃ 45 s;溶解曲 线 60 ~ 95℃ , 加热速率 0. 1℃ / s, 管家基因为 βactin,实验重复 3 次。 定量分析实时荧光定量 PCR 分别测定目的基因 Dectin-1、NLRP3、caspase-1 及内 参 β-actin 的 Ct 值,实验结果取其平均值,用 2 -ΔΔCt来表示基因表达量变化。 3.2.5 Western blot 检 测 Dectin-1、 Syk、 NLRP3、 ASC、pro-caspase-1、caspase-1 蛋白表达 取 6 孔板 细胞置于冰上,每孔加 200 μl 含 PMSF 的 RIPA 裂 解液,用干净的刮刀将细胞刮于 EP 管中,冰上裂解30 min,于 4℃ 下 12 000 r/ min 离心 15 min,之后加 蛋白上样缓冲液,沸水煮 5 min,冷却后,电泳 80 V, 30 min;120 V,55 min,转膜 120 V,1 h 30 min,室温 封闭 2 h,4℃过夜孵一抗,二抗室温孵育 2 h,洗膜,曝光成像,通过 Image J 软件分析得出蛋白 IOD 值,并根据目的蛋白 IOD/ 内参蛋白 IOD,计算目的蛋白 相对灰度值,进行统计分析。 3.2.6 ELISA 法检测巨噬细胞培养液中 IL-1β 和 IL-18 的含量 根据试剂盒说明书要求,将细胞悬液 于3 000 r/ min 离心10 min 去除颗粒和聚合物;设置 标准品孔,样本孔,标准品孔加入不同浓度标准品 50 μl,待测样品孔里先加入待测样品 10 μl 再加样 品稀释液 40 μl;随后每孔加入 HRP 标记的检测抗 体 100 μl,封板,37℃温育 60 min;弃液体,反复洗涤 5 次,拍干;每孔加入底物 A、B 各 50 μl,37℃避光温 育 15 min;每孔加入终止液 50 μl,15 min 内 450 nm 04主要结果 4.1 丹皮酚对 β-1,3-D-葡聚糖诱导的 RAW264. 7 巨噬细胞增殖活性的影响 如图 1,MTT 法细胞增 殖活性检测结果表明,与空白对照组相比,β-1,3-D葡聚糖在 70 μg / ml 浓度能够明显抑制 RAW264. 7 巨噬细胞生长,细胞存活率 下降 50% ,差异具有统 计学意义(P<0. 001)与 β-1,3-D-葡聚糖诱导模 型组相比,丹皮酚在480μmol / L浓度能够明显促进RAW264. 7 细胞增殖活力,细胞存活率上升,差异具 有统计学意义(P<0. 001)。
图 1 丹皮酚对 β-1,3-D-葡聚糖诱导的 RAW264.7 巨噬细 胞增殖活性的影响(n=6)
4.2 丹皮酚对 β-1,3-D-葡聚糖诱导的 RAW264. 7 巨噬细胞形态学的影响 如图 2,在 400 倍倒置显 微镜下观察,空白对照组细胞体积偏小,呈现饱满圆 润形态;β-1,3-D-葡聚糖诱导模型组细胞分化严重, 细胞体积增大,形态多不规则,有“伪足”伸出,细胞 过于 狭 长, 有 的 甚 至 呈 梭 形; 丹 皮 酚 干 预 组 细 胞分化明显改善,细胞体积变小,“伪足”现象明显减少,细胞大部分恢复至近圆形状态。
图 2 丹皮酚对 β-1,3-D-葡聚糖诱导的 RAW264.7 巨噬细 胞形态学的影响(n=6,×400)
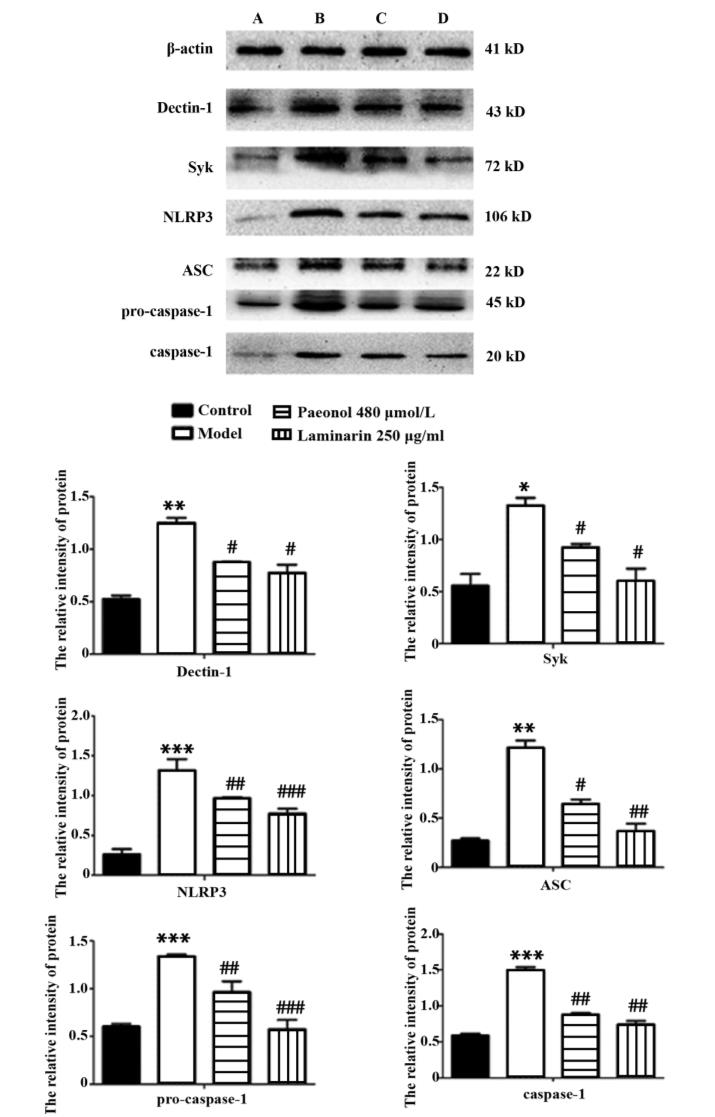
4.3 丹皮酚对 β-1,3-D-葡聚糖诱导的 RAW264. 7 巨噬细胞 Dectin-1、Syk、NLRP3、ASC、pro-caspase-1、 caspase-1 蛋白表达的影响 如图 3,与空白对照组 相比, β-1,3-D-葡聚糖诱导模型组 Dectin-1、 Syk、 NLRP3、ASC、pro-caspase-1、caspase-1 蛋白表达量明 显升高,差异具有统计学意义(均P <0.05 )与 β1,3-D-葡 聚 糖 诱 导 模 型 组 相 比, 丹 皮 酚 干 预 组Dectin-1、 Syk、NLRP3、ASC、 pro-caspase-1、 caspase-1 蛋白表达量明显降低,差异具有统计学意义(均 P< 0. 05)。
图 3 丹皮酚对 β-1,3-D-葡聚糖诱导的 RAW264. 7 巨噬细 胞 Dectin-1、 Syk、 NLRP3、 ASC、 pro-caspase-1、 caspase-1 蛋白表达的影响(n=3)
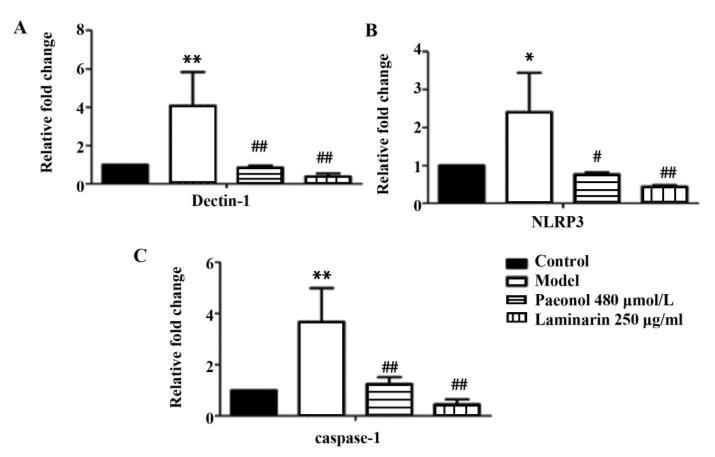
4.4 丹皮酚对 β-1,3-D-葡聚糖诱导的 RAW264. 7 巨噬细胞 Dectin-1、NLRP3、caspase-1 mRNA 表达的影响 如图 4,与空白对照组相比,β-1,3-D-葡聚糖 诱导模型组 Dectin-1、NRP3、caspase-1 mRNA 表达量 明显升高,差异具有统计学意义(均P <0.05 )与 β-1,3-D-葡聚糖诱导模型组相比,丹皮酚干预组 Dectin-1、NLRP3、caspase-1 mRNA 表达量明显降低, 差异具有统计学意义((均P <0.05 )
图 4 丹皮酚对 β-1,3-D-葡聚糖诱导的 RAW264. 7 巨噬细胞 Dectin-1、NLRP3、caspase-1 mRNA 表达的影响(n=3)
4.5 丹皮酚对 β-1,3-D-葡聚糖诱导的 RAW264. 7 巨噬细胞分泌 IL-1β、IL-18 的影响 如图 5,与空白 对照组相比,β-1,3-D-葡聚糖诱导模型组细胞分泌 的 IL-1β、IL-18 水平明显升高,差异具有统计学意义 (P <0.01 )与 β-1,3-D-葡聚糖诱导模型组相比,丹 皮酚干预组细胞分泌的 IL-1β、IL-18 水平明显降低, 差异具有统计学意义((均P <0.05 )
图 5 丹皮酚对 β-1,3-D-葡聚糖诱导的 RAW264.7 巨噬细胞分泌的 IL-1β、IL-18 的影响(n=3) 05讨论 β-1,3-葡聚糖是真菌细胞壁的主要成分,并在真菌过度增殖或死亡时从细胞壁脱落,通过与巨噬细胞表面受体结合诱导炎症因子产生[18-20] 。 巨噬细胞则是 通 过 模 式 识 别 受 体 ( pattern recognition receptors,PRRs)来识别 β-1,3-葡聚糖,并分泌炎症 因子以促进炎症反应发生[21] 。 PRRs 分细胞膜外和 细胞膜内,膜外以 Dectin 家族受体研究较多,膜内 则以 NOD 样受体(NOD-like receptor,NLR) 备受关 注[22] 。 其中 C 型 凝 集 素 结 构 域 家 族 7 成 员 A (CLEC7A;也称为 Dectin-1)是 C 型凝集素受体家族 的 PRRs, 识别真菌细胞壁上暴露的 β-1, 3-葡聚 糖[23,24] 。 NLRP3 也叫 NOD 样受体蛋白 3,属于炎性 复合体的传感蛋白[25] 。 当细胞受到感染刺激时,被 激活的 NLRP3 形成 NLRP3 炎性小体,在炎性小体 的作用下,促进下游炎性细胞因子 IL-1β 和 IL-18 的 释放从而引起炎症反应[26-28] 。 新近研究表明,肠道真菌变化与 ALD 存在密切 关联,长期酒精刺激后,肠道真菌菌群紊乱,真菌过 度生长,β-葡聚糖作为许多共生真菌细胞壁的主要 成分,通过肠屏障,经门静脉转运到肝脏,与肝巨噬 细胞上的受体 Dectin-1 结合,激活 NLRP3 炎症小 体, 释 放 IL-1β 和 IL-18 诱 发 小 鼠 ALD 炎 症 损伤[5,29] 。 在前期体内实验中,我们通过 Lieber-DeCarli 酒 精液体饲料喂养 C57BL / 6 小鼠建立 ALD 模型,发现酒精喂养导致肠道真菌失调,真菌丰度增加,血清 中 β-1, 3-D-葡 聚 糖 水 平 升 高, 肝 脏 中 Dectin-1 / NLRP3 信号通路上相关蛋白表达量增多,发生 ALD 炎症反应。丹皮酚干预后,肠道真菌失调得到改善,血清中 β-1,3-D-葡聚糖水平降低,肝脏中 Dectin-1 / NLRP3 信号通路上相关蛋白表达量减少,ALD 炎症 反应得到缓解。 我们推断丹皮酚抗 ALD 炎症损伤 可能与抑制 β-1,3-D-葡聚糖介导的 Dectin-1 / NLRP3 信号通路存在相关性。 为了验证丹皮酚是否通过阻断 Dectin-1 / NLRP3 信号通路来预防由 β-1,3-D-葡聚糖引起的 ALD 炎 症损伤,我们应用 β-1,3-D-葡聚糖诱导 RAW264. 7巨噬细胞建立体外 ALD 炎症损伤模型,在 β-1,3-D葡聚糖诱导 RAW264. 7 巨噬细胞 24 h 后,观察丹皮 酚在造模前干预下能否对 β-1,3-D-葡聚糖致炎起到 预防保护作用,并检测 Dectin-1 / NLRP3 信号通路相 关蛋白是否发生改变。 我们还应用了 Dectin-1 阻断 剂昆布多糖来验证 β-1,3-D-葡聚糖刺激效果。 实验 研究表明,通过 MTT 法检测细胞增殖活性与倒置显 微镜形态学观察发现 β-1,3-D-葡聚糖诱导下的 RAW264. 7 巨噬细胞发生炎症损伤,细胞增殖活力 减弱,细胞存活率低下,而丹皮酚干预后能有效缓解 并改善 RAW264. 7 巨噬细胞的炎症损伤,提升细胞 增殖活力。 为了探究丹皮酚抗炎症损伤的作用机 制,并依据前期的体内实验,我们从 β-1,3-D-葡聚糖 结合受体 Dectin-1 为切入点,进而涉及 Dectin-1 / NLRP3 相关信号通路。 经实验证实,β-1,3-D-葡聚 糖诱 导 24 h 后 的 RAW264. 7 巨 噬 细 胞 中 存 在 Dectin-1 / NLRP3 信号通路激活,相比于空白对照 组,β-1,3-D-葡聚糖诱导模型组 Dectin-1 / NLRP3 信 号通路相关蛋白诱导 Dectin-1、 Syk、NLRP3、ASC、 pro-caspase-1、caspase-1 以及炎症因子 IL-1β、IL-18 都明显升高。 而丹皮酚干预 24 h 后可显著降低 β1, 3-D-葡 聚 糖 诱 导 的 RAW264. 7 巨 噬 细 胞 中 Dectin-1、 Syk、NLRP3、ASC、 pro-caspase-1、 caspase-1 蛋白表达水平和 Dectin-1、NLRP3、Caspase-1 mRNA表达水平,以及细胞分泌的 IL-1β、IL-18 水平。 提示 丹皮酚能显著预防 β-1,3-D-葡聚糖诱导所致的 RAW264. 7 巨噬细胞炎症反应,从而缓解和改善细 胞增殖活力减弱与细胞损伤, 推测可能与阻断 Dectin-1 / NLRP3 信号通路的激活有关,以上实验结 果与前期体内实验结果一致。 通过体内、体外实验 验证,我们可以推定丹皮酚是通过抑制 β-1,3-D-葡 聚糖,阻断 Dectin-1 与之结合,进而抑制 NLRP3 炎 症小体激活,从而使巨噬细胞分泌 IL-1β、IL-18 水平 降低,缓解 ALD 炎症损伤。 与 Xiao 等[30] 报道的肠 道细菌菌群失调导致 LPS 与 TLR4 结合,并激活核 因子 NF-κB 诱导的 ALD 炎症损伤相比,我们的研究 是基于肠道真菌菌群及其代谢产物 β-1,3-D-葡聚糖 在 ALD 中的显著作用,因此,改善肠道真菌菌群,抑 制 β-1,3-D-葡聚糖已经成为预防 ALD 的重要的治 疗靶点和潜在手段。 总之,丹皮酚可能通过抑制 β-1,3-D-葡聚糖诱 导的巨噬细胞 Dectin-1 / NLRP3 信号通路上 Dectin1、Syk、NLRP3、ASC、pro-caspase-1、caspase-1 的表达 从而有效降低终末炎症因子 IL-1β、IL-18 的释放, 进而有效抑制 ALD 炎症反应。 我们的实验数据进 一步验证了丹皮酚可以预防 ALD 炎症损伤,深入探 讨了丹皮酚对肠道真菌代谢产物 β-1,3-葡聚糖相关 的 Dectin-1 / NLRP3 信号通路关键蛋白的调控作用, 为将其开发成新型的抗 ALD 药物提供新的研究思 路和重要的实验依据。
|